摘要:
白细胞与内皮细胞的黏附是一个多步骤、序贯性的过程,进程中的生物力学相互作用对血液流变产生重大影响,低剪切力环境的形成在一般炎症中有着至关重要的意义。
上世纪80年代末,白细胞与血管内皮细胞相互作用的分子机制得以阐明,人们逐渐认识到在炎症中各种白细胞与血管内皮细胞之间存在着非常复杂的相互作用,白细胞与血管内皮细胞的相互作用对机体各种功能的发挥、各种疾病的发生发展起着至关重要的作用。白细胞与血管内皮细胞相互作用的分子基础及其临床意义已成为当前的研究热点之一。
白细胞的趋边、粘附及其运动的行为,都是在血液流动过程中进行的,除与生化因素有关外,力学因素也很重要。白细胞在进入组织间隙前,需要靠近血管壁,然后穿过管壁进入组织间隙,这样似乎白细胞容易在毛细血管内皮层接触时进入组织间隙,但实际上白细胞却在毛细血管后静脉段进入组织间隙。发生这一现象的原因,应在生物流变行为中去寻找。因此,我们认为,白细胞在机体内发挥其生理功能时,与其在血液流动中的流变行为有密切关系。
一、激活的白细胞对炎症灶毛细血管流变的影响
(1)内皮细胞的激活是白细胞激活和黏附的先导
不同诱因造成的骨骼肌微损伤都可以通过信号转导途径激活免疫系统,引起白细胞黏附到内皮细胞上。其中内皮细胞功能的变化是早期的变化,先于内皮细胞-白细胞的相互作用。当损伤组织中分泌的炎性因子扩散到血管周围,一部分可以透过血管壁释放入血液中,还有一部分被内皮细胞所感受,内皮细胞因此发生一系列变化并启动黏附程序:一方面从自身的mRNA改变、细胞骨架的改变等一系列的胞内变化为初始黏附做好准备,另一方面分泌相关因子激活并诱导白细胞发生一系列改变开始初始黏附的进程。
(2)正常状态下白细胞对微循环的影响
白细胞由于在血中浓度很低,对大血管中血液黏度基本不起作用。但是在毛细血管则不同,血细胞需要单个通过,且与血管内皮十分靠近,甚至发生接触,红细胞和白细胞由于体积大,需要变形才能通过毛细血管。白细胞的硬度和胞浆黏度均比红细胞高数百倍以上,由于有细胞核,不能像红细胞那样折叠弯曲。在正常情况下,白细胞进入毛细血管时,血流可有短暂的停顿:白细胞进入毛细血管时,先伸出小舌进入管内,偶而可见到细胞内颗粒流到细胞前端,然后整个白细胞进入腔内。在毛细血管入口处,它由圆形变成长柱形才能适应毛细血管的口径和形态,通过毛细血管;如果白细胞不能及时变形,白细胞将在入口处暂停;白细胞甚至已经接触到毛细血管入口处,但不能及时进入管腔,引起毛细血管血流暂停。白细胞对毛细血管血流的这种干扰,是引起毛细血管间歇流的主要原因之一。
白细胞进入毛血管时91%的停顿发生在毛细血管入口处,11%发生在毛细血管内,平均停顿时间0.24s。一个白细胞产生的阻力与多个红细胞所致的阻力等值,—个白细胞进入微血管中,能使微循环网中的红细胞发生重新分布,改变对组织氧的运送。在血管分支处,一个白细胞进入了一个分支,则该支血流阻力增加,致使后面来自母血管的红细胞进入另一分支直到两侧血流阻力相等。经常在毛细血管中的白细胞前面可以看到血浆柱,而在白细胞后面,紧接着有一大串红细胞堆积形成列车样流动。但正常情况下不发生白细胞嵌塞至血流完全停止。
影响白细胞通过毛细血管的因素包括:白细胞黏附性和变形性、白细胞硬度、白细胞黏度、平均毛细血管口径(不同脏器毛细血管口径不同)和狭窄处(如内皮细胞核向管腔隆起部)口径、临界压力(剪切力)、以及是否有红细胞聚集等。由于白细胞的上述流变特性,使得白细胞的数量仅占血细胞的百分之0.1,但却是毛细血管灌注中的重要调节因素。
(3)在炎症中激活后的白细胞对微循环的影响
当白细胞流经炎症灶的微血管时,可以感受到多种炎性因子的刺激而进入激活状态,激活程度与炎症灶炎性因子的强度密切相关;逐渐释放入血的炎性因子也对血液中的白细胞有一定的激活作用。当炎症灶虽然面积较小但损伤程度高,或者是损伤轻微但面积比较大,在炎症出现一段时间后,全身血液循环中激活的白细胞比率就逐渐上升,白细胞数量增加也会随后增加,进而对毛细血管的血液流变产生重大影响。
激活的白细胞形态出现多样化,细胞硬度增加,颗粒的无规则运动减少,但细胞有伪足伸出,使其定向变形能力增强。由于炎症中的白细胞变大变圆、细胞膜的表面积相对减少,因此变形能力降低,此时如有微血管内皮细胞的肿胀、微血管痉挛等附加因素,则白细胞易在毛细血管中发生阻塞,影响相应区域微循环的灌流。在某些病理条件下,随着毛细血管两端血压降的下降使得白细胞流动变形的驱动压减低,从而可造成微循环中发生白细胞嵌塞。
当末梢微循环血流严重阻碍时,白细胞的病理生理意义就更为突出了。不仅仅是因白细胞变形的力不足而难以强行快速地流过毛细血管,更糟的是此时的白细胞很容易造成毛细血管的完全阻塞:在正常时,很少见到围绕细胞的几根毛细血管同时被阻塞,白细胞流变对区域性血流的影响未必很大;但在病理情况下,当驱动压力较低,白细胞粘附于血管壁的倾向性增高时,此时白细胞可以构成毛细血管血流的重要障碍物。
(4)白细胞在毛细血管中的激活
离体实验证明,白细胞介素8(IL-8)、趋化寡肽(fMLP)、C5a等炎性介质在家兔血管内注射后,与白细胞膜相应受体结合,在0.5~2.0分钟内,使微丝的肌动蛋白单体(G-肌动蛋白)发生聚合,形成纤维状F-肌动蛋白,在胞浆膜下形成一个壳状物,从而使白细胞体积增加,变形能力下降,细胞硬度增大。上述变化可被微丝组装的抑制剂细胞松弛素B(cytochalasin B)所抑制。
在毛细血管等狭小的血管腔,白细胞膜与血管内皮的密切靠近和接触已能提供趋化因子、整合素作用的时机。正常流态的毛细血管在正常生理驱动压下可保证变形的白细胞与内皮细胞之间保留薄层液体空隙,阻止白细胞的粘附。一旦驱动压梯度减少,或者白细胞变形能力明显减弱,使其不易在血流冲击下通过比其自身尺寸小的毛细血管,不仅很容易造成白细胞在毛细血管中的堵塞,血流缓慢或暂停,形成白细胞嵌塞(Leukocyte plugging),而且促使白细胞在炎性因子作用下的充分激活,从而与已经激活的血管内皮细胞发生粘附。白细胞与内皮细胞之间黏着应力(adherence stress,δ)是阻碍白细胞通过毛细血管的重要因素,阻断了的毛细血管血浆流产生的剪切力更加微弱,无法推动白细胞,于是白细胞就扣留在毛细血管中。黏附于内皮细胞的白细胞可进一步激活并变形迁移进入组织。
(5)水肿对白细胞流经毛细血管中的影响
病理情况下,内皮细胞可以发生肿胀,甚至突向管腔。在缺血损伤时,组织切片见心、肾、肌肉的毛细血管内皮肿胀。内皮细胞肿胀主要是由于细胞缺氧和缺少能量,使Na+-K+泵功能障碍,细胞内水、钠增多所致;酸中毒致Na+-H+交换增加也参与其发生。内皮细胞肿胀挤占了血液流动的空间,毛细血管内径缩小到一定程度使得血细胞无法通过时,相当于流动阻力无限大。内皮细胞肿胀使白细胞嵌塞是休克治疗后血压恢复而毛细血管仍然无复流和功能性毛细血管密度(functional capillary density,FCD)减少的重要原因。
炎症中由于血管壁通透性增大而造成组织液生成增多,组织间隙的组织液聚积(水肿)挤压微血管,导致毛细血管管径变窄,引起血细胞通过时阻力增大,红细胞通过时间延长,白细胞通过时间延长更为显著;这就影响到毛细血管内的血液成分流动,出现停滞-再运动的现象,甚至完全停滞在毛细血管中,可造成细静脉的血液来源减少,流速下降。这一现象更易出现在液体在细胞间隙聚集后不易扩张的组织,如脑、有紧密的筋膜鞘包围的骨骼肌、肾等组织。
包括直捷通路这些细小的血管,组织水肿压迫管壁外侧引起的管径狭窄将迅速增大血液流动的阻力,当小动脉入口处的血压不变时,这些细小血管的流量迅速减小,引起细静脉的血液来源减少,流速下降。
二、临近毛细血管的细静脉中白细胞的趋边现象
(1)白细胞到达细静脉的通路之分析
骨骼肌微血管的空间架构和血流控制机构的分布对微循环的流变状态具有重大的影响。新的研究一般认为骨骼肌微循环的血流控制由基本微血管单元MVUs构成。一个微血管单元由一个微动脉(小的细动脉)、一个毛细血管网络,一个(或两个)微静脉(小的细静脉)组成,一个微血管单元的毛细血管网络大约包括10~20个毛细血管。骨骼肌中毛细血管灌注的调节由MVUs的控制实现,微动脉控制血流的流量,而毛细血管前括约肌的开闭调整毛细血管灌流数量,控制进入微循环毛细血管网的血流量使之和物质代谢程度相适应,担当着基础的控制和分配元素的功能。
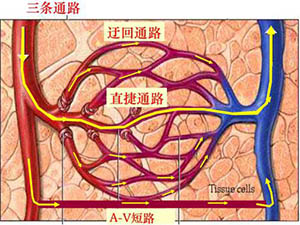
直捷通路(thoroughfare channel)是微动脉的直接延伸,其管壁平滑肌逐渐稀小以至消失,结构与毛细血管相同,只是管径略粗。这条通路较直,流速较快,加之直捷通路血管管壁较厚,又承受较大的血流压力,故经常处于开放状态。在组织处于静息状态时,微循环的血流大部由微动脉直捷通路快速入微静脉,只有小部分血液流经真毛细血管。当组织处于功能活跃时,毛细血管前括约肌开放,大部分血液流经真毛细血管网,血液与组织之间进行充分的物质交换。
由细动脉主干流入“直捷通路”与“迂回通路”共同的细动脉分支(俗称“微动脉”)的血细胞,一部分由“迂回通路”流到细静脉,而没有流入到“迂回通路”中时,就只有通过“直捷通路”流到细静脉。经过“直捷通路”流到细静脉的血细胞有更重要的意义:当“迂回通路”血流不通畅的情况时(如水肿、毛细血管闭塞等),特别是硬度高、不易变形进入“迂回通路”的毛细血管入口的白细胞,“直捷通路”是其通过的主要通道。白细胞穿过血管壁而进入组织是炎症期间的重要特征,症状严重时,单位时间穿过血管壁的白细胞数量更多,需要有通路向微静脉不断补充白细胞,才能维持炎症的症状。而此刻随着组织肿胀的加剧,毛细血管更加狭窄,红细胞亦难以通过,更何况白细胞?因此,毛细血管是难以胜任此刻这个通路的职责的,只有直捷通路输送白细胞到达微静脉这一种可能性。
通过以上对微循环血管网结构的分析,我们认识到“直捷通路”是在炎症期间输送大量白细胞到达毛细血管后段及临近的细静脉的重要途径。
(2)临近毛细血管的细静脉中白细胞的趋边现象研究
以前的研究一般认为:在白细胞黏附的血管区段所出现的白细胞趋边现象,是由于血液流速变缓、切变率下降使得轴流现象不能维持的缘故,或是由于红细胞的聚集把白细胞推向周边。但仔细分析,认为应用“轴流现象”来解释此处的“白细胞趋边现象”实在是很牵强,因为在这个区段的血液流变是很难发生轴流现象;轴流这种亚稳态现象的形成需要一段相对较长的管道,并且与血液的切变率大小密切相关,后微静脉自毛细血管端开始的流变长度不足和较低的切变率是难以达到这个条件的。而且红细胞刚刚从毛细血管中被一个一个地序贯释放出来,或者是由直捷通路序贯而来,不可能迅速地就发生显著的聚集现象,由于出现显著的聚集现象需要一定的的碰撞几率和碰撞空间来实现,这两个条件在细静脉靠近毛细血管的区段都不能满足;否则,一旦红细胞出现如此强烈的聚集倾向,则在略大的细静脉中更容易聚集成团而威胁到循环系统的基本功能;由此,用红细胞的聚集来解释白细胞的趋边现象,是不能使用在临近毛细血管的细静脉这个区段上的。
发生在毛细血管中的白细胞流变现象是这种情形:白细胞通过毛细血管时会出现停顿、甚至是嵌塞现象,白细胞前面出现血浆柱,后面则跟随着一串象火车一样的红细胞,血液在毛细血管的血压降主要集中在白细胞上。当白细胞流出狭窄的毛细血管进入到一个管径较大的区域中时,白细胞与内皮细胞之间的阻力将迅速减小、甚至消失,原来施加在白细胞上的血压降转移到后面的红细胞上,由于红细胞的变形性很好,可以顺利通过毛细血管,于是红细胞及毛细血管中的血浆被快速推动起来,红细胞“顶”着前面的白细胞加速,后面的红细胞又推动前面的红细胞加速,这样就使得前端的血细胞不断地被后面的红细胞挤离流场中部,出现了白细胞的趋边现象。
而由直捷通路来的白细胞进入到细静脉时,管径突然变得宽阔,流速也变缓慢,其流态与从毛细血管中流出很相似,于是也表现出白细胞的趋边现象。
三、白细胞的初步激活及在内皮细胞表面的滚动
当白细胞趋边时,一方面由于组织内通过血管壁释放到血液中的可溶性炎症因子和内皮细胞激活后释放到血液中的可溶性炎症因子浓度的升高而对白细胞产生更强烈的刺激,另一方面白细胞可以直接与激活的内皮细胞的表面上的炎症因子发生接触而感受刺激:内皮细胞表面的糖蛋白中富含(硫酸)肝素糖胺多糖(heparin/heparansulfate glycosaminoglycan,GAG),可与化学激动剂分子结合的位点结合,流经血液中的趋化因子常锚泊于内皮细胞表面,当白细胞接触到内皮细胞时,锚泊于内皮细胞表面的趋化因子可以就近、更有效的作用于白细胞上的受体可促进趋化因子对白细胞受体的作用;组织中的巨噬细胞或肥大细胞聚集到炎症部位并释放IL-1、TNF、组胺和TGF-β等活性物质激活内皮细胞,激活后的内皮细胞可释放一系列的相关因子激活白细胞;另外,内皮细胞还能通过细胞转运,将血管外周成纤维细胞、角质细胞等分泌的化学激动剂(如IL-8)转运到血管内腔表面,这就使得血管外周组织分泌的化学激动剂也能被递呈于血管内侧。这些都有助于加强白细胞的激活。激活后的白细胞还可以通过与内皮细胞的接触而发生信号转导,强化内皮细胞的激活。初步激活的白细胞和内皮细胞进入到初始黏附的进程。
正常情况下,内皮细胞的选择素不表达或低表达,而化学介质的激活作用可以诱导其表达或调高表达。如P-选择素素,正常位于内皮细胞内的Weibel-Palade小体,在组胺、凝血素、血小板激活因子(PAF)等介质的作用下,P-选择素快速(数分钟内)分布到细胞表面,利于与白细胞结合。同样,正常的血管内皮细胞E-选择素不表达,而炎性介质(如IL-1和TNF)可以诱导其合成和表达,促进内皮细胞与白细胞结合,但此过程需要合成新的蛋白质,并且通常在1~2个h后才开始。L-选择素在白细胞表面的表达较为固定,不易受其他因素的影响;L-选择素的配体可在TNF、LPS等炎症介质作用下,在内皮细胞表面表达增多,从而有利于L-选择素介导的黏附。
由于选择素与配体的动力学不同,不同的选择素在炎症反应的不同阶段起作用。在早期(<20min)主要由P-选择素介导,L-选择素只是部分参与,E-选择素几乎不起作用,这与P-选择素从内皮细胞上快速释放相一致。其后(>20min)滚动主要由L-选择素介导,P-选择素的作用降低。E-选择素在炎症反应后2~4小时起作用,其表达具有组织部位特异性。各种选择素在作用时间上的重叠使它们能协同作用提升效率。
在体内L-选择素参与白细胞的快速(50~150μm/s)滚动,E-选择素参与慢速(3~10μm/s)滚动,P-选择素参与中间速率(20~50)m/s)滚动。这种速度差异可以使白细胞在L-选择素的介导下慢速滚动,L-选择素介导的滚动使P-或E-选择素介导的滚动变得容易并增强了后二者的作用。然而好的、稳定的白细胞滚动则需要L-、E-和P-选择素的协同作用,正是3种选择素的共同作用,白细胞才能与内皮细胞接触并滚动。这是白细胞粘附的开始一步,而L-选择素在白细胞粘附中起“锚”的作用,由于L-选择素与其配体结合的亲和力低,加上白细胞活化后,L-选择素的细胞外域会在滚动发生的几秒钟后随即脱落(shedding),使白细胞并不与内皮细胞发生牢固黏附。滚动的白细胞流经炎症部位微静脉的速度较正常流动的白细胞慢得多,因此有更多的机会与微静脉内皮细胞紧密接触,而悬浮的白细胞在各种刺激因子作用下虽然也有激活,但较与内皮细胞接触后受刺激激活的强度和持续时间上相差很多。这种滚动对白细胞进一步的活化是必要的,使白细胞通过损伤区的速度持续减慢,使白细胞与内皮细胞有时间活化或获得趋化的信号。
四、白细胞与内皮细胞的初始黏附对血液流变的影响——血液黏度的上升与流速的降低
炎症发生时,在临近毛细血管的细静脉中会出现“血液浓缩、粘滞性增加”的现象,以往对其原因的分析是“由于血管通透性升高,血浆从微静脉外逸。”恒怡运动团队经过仔细研究认为:导致血液粘稠的较主要原因可能不是由于血浆从血管内向组织间隙的流失。因为血液逐渐变粘稠是一个持续时间很长的过程,而流入的血液一般具有正常的黏度,如果导致血液变粘稠的丢失血浆全部转变成了组织液,试想那将是一个多么大的液体总容量,即使能从淋巴管排走一部分,剩下的超量容积能在组织间隙中存留下来吗?
恒怡运动团队认为:造成上述现象的原因需要从白细胞与内皮细胞黏附进程中的生物力学相互作用中去探究。选择素发挥作用后不断降低着白细胞的前行速度,尤其是L-选择素的持续“黏着-脱落”产生的制动力就象汽车行进中的“点刹”方式一样,所形成白细胞前进的阻力可引起白细胞速度的持续下降,因而在相对狭窄的细静脉中将对血液流态产生影响:血浆中的水分子等小分子由于个体小,与白细胞表面的黏滞阻力低,故对整体血浆所造成的速度损失较小,因而相对快速地向前流走了;红细胞由于体形巨大而与降速的白细胞发生碰撞等过程后显著地降低了流动速率,相对地停滞下来。这种模式从整体上可以近似看成是红细胞和血浆的分流,红细胞被抑留下来,会造成单位空间中红细胞数量增加,相当于红细胞的比容提高。当红细胞比容上升后,血液的黏度将急剧增加,导致血液流动阻力增加,引起血液流速变缓慢。同样,血浆中的大分子也存在一定程度的抑留,浓度上升,引起血浆黏度升高,也会导致血液流动阻力增加。
随着血液流速降低,红细胞受到的剪切力下降而致使变形能力降低,也是导致血液黏度上升一个因素。
正常时红细胞悬浮在血浆中,呈均匀状态,红细胞间不发生聚集,这是因为每个红细胞表面均带负电荷,但是炎症时由于致炎因子直接作用于红细胞,使红细胞表面带电减少,可促使红细胞发生一定程度的轻微聚集。当血流速度低时,红细胞聚集的几率升高,也是导致血液黏度上升一个因素。
血液在细静脉黏度的升高造成在本段血管的血压降的增高及细动脉到本段的血压降的减低,致使流入本段血管的血液量减少,进一步促进了本段血管中血液流速的降低和黏度的上升。血液黏度的上升与流速的降低的幅度和速度主要与白细胞-内皮细胞的激活程度和选择素的作用强度密切相关,这个进程一直持续发展到流入的血细胞与流出的血细胞达到基本的动态平衡。
五、血流缓慢对白细胞黏附的影响
血液流速降低后,白细胞在内皮细胞表面滚动的速度减缓,选择素接触的机会增多,使白细胞、内皮细胞充分激活。如中性粒细胞在选择素介导下放慢滚动速度时,它会更有效地与内皮细胞上的趋化物质IL-8、PAF等结合,使β2整合素发生变构效应而激活。在β2整合素的介导下,中性粒细胞与内皮细胞牢固地粘附。同时内皮细胞上的ICAM-1表达上调,有利于整合素介导牢固粘附。
研究证明剪切力诱导内皮细胞IL-8 mRNA表达是时间和剪切力大小依赖性的,高剪切力可抑制IL-8 mRNA表达。血管内皮细胞表达IL-8需要流体剪切力的作用,而且IL-8蛋白质的表达量与剪切力的作用时间和作用强度有关。IL-8蛋白质的分泌量与剪切力强度呈反变关系,低剪切力(2.09dyne/cm2)时,IL-8蛋白质的表达量明显增加,为高剪切力(18.32dyne/cm2)时IL-8蛋白质的表达量的约6~7倍。IL-8是迄今为止发现的趋化细胞因子中对中性粒细胞作用特异性强的一种,也是中性粒细胞强的刺激剂之一。血流缓慢形成的低剪切力环境有利于增加中性粒细胞的激活程度和黏附数量。
血管壁上的内皮细胞中编码单核细胞趋化蛋白质(MCP-1)蛋白的基因在没有剪切力作用时是失活的。血液的层流剪切力会导致内皮细胞的MCP-1及多种增生基因的迅速上调。低剪切力促进了内皮细胞分泌大量的MCP-1趋化单核细胞黏附到内皮细胞上。
LFA-1、Mac-1属于白细胞β2-整合素。低剪切力可使LFA-1、Mac-1表达明显增加,而随着剪切力的增加,LFA-1、Mac-1表达明显减少,这些结果与内皮细胞IL-8表达随剪切力强度而变化的规律是相同的。而IL-8可以激活中性粒细胞,上调LFA-1、Mac-1的表达。因此,可以推测血流缓慢时降低剪切力可通过影响内皮细胞分泌IL-8来增强中性粒细胞表面LFA-1、Mac-1的表达,进而加强中性粒细胞-内皮细胞黏附。
六、白细胞在内皮细胞表面的滚动中的再次激活
当缓慢滚动的白细胞暴露在内皮细胞快速表达的PAF、白三烯等因子的环境下,可提高L-selectin的脱落水平。L-选择素与配体的结合在白细胞起始黏附过程中的作用不仅表现为它们作为锚定分子将白细胞捕获到活化的内皮细胞上,同时,L-选择素作为信号受体还可向白细胞内传递信号,参与白细胞的活化。随着L-selectin的脱落,白细胞表面β2-整合素的表达和活化也相应增加。受激表达的CD11/CD18结合内皮细胞表面上的ICAM-1,而β2-整合素/ICAM-1的粘附作用在数分钟内促使白细胞牢固粘附并游行到炎症组织中。
触发是白细胞整合蛋白的激活,只有活化的整合蛋白才能促进强烈的粘附,从而使滚动的白细胞停止下来,使一过性的滚动转变为紧密黏附,发展到牢固黏附。白细胞和内皮细胞固定黏着后,触发了一系列信号事件:活化的白细胞在内皮表面变得扁平,微管重新组装,在伪足部充填了肌动蛋白,用微吸管技术证明伪足比细胞体有更高的硬度;而且白细胞变得扁平,增加整合蛋白介导的连接的接触面积,降低血流的牵引力;黏附以后也激发了血管内皮细胞之间信号传递,如白细胞CD11/CD18黏附蛋白与内皮细胞相应配基(ICAM-1)结合后,引起内皮细胞的细胞骨架重建(remodeling),增加了内皮细胞的黏度。内皮细胞和白细胞在促炎细胞因子和炎症介质的作用下被进一步激活,细胞粘附分子表达增多,如内皮细胞激活后其表面的ICAM-1可增加30倍,而E-选择素可增加100倍。白细胞被激活后,不仅膜表面的整合素家族黏附分子LFA-1和VLA-4增多,整合素构象也发生变化,使其与配体结合的亲和力增高。激活的白细胞与内皮细胞依赖于表面黏附分子对的结合(如α1β2-ICAM-1,2,3、α4β1-VCAM-1)发生牢固黏附。
七、牢固黏附形成对血液流变的影响:
当牢固黏附出现后,这种粘附力可达0.004N/cm2(400dyn/cm2),在低血流状态时,不可能有足够大的剪切力驱开牢固粘附的白细胞。白细胞粘附到血管的管壁上,犹如河床底部铺上了许多石头块一样,严重时贴壁粘附的白细胞沿微血管壁“成队排列”,临床上可观察到炎症引起的微循环紊乱往往有一层相当厚的中性粒细胞位于静脉壁处。而且已黏附于内皮细胞的白细胞可以像活化的内皮细胞一样支持白细胞的滚动。
由于白细胞粘附于管壁,使得该处的有效管腔明显减小,尤其在细静脉分叉处,粘附的白细胞使管腔变窄。平时这些血管段的流动阻力较低,但此时也表现出较高的阻力。毛细血管后的细静脉的血流阻力将显著增加,据Eriksson计算可增高200多倍。毛细血管前段与后段的阻力比值的偏移可引起毛细血管内压力的自动升高,随后又造成向组织间隙渗滤的增加。这些情况也可导致前已述及的局部血液浓缩现象,这是解释烧伤后细静脉淤血和水肿发生的一种新的机制,也是促成毛细血管淤血的原因之一。当末梢微循环血流严重阻碍时,白细胞的病理生理意义就更为突出了:不仅仅是使细胞变形的剪切力不足以强迫白细胞快速地流过毛细血管,更糟的是此时的白细胞很容易造成毛细血管的完全阻塞,从而促进微循环血流淤滞的发生,造成细胞和组织的缺氧性损伤。而血流缓慢,引起血液的剪切力下降,进一步促进了白细胞黏附数量的增多,后期可使血流停滞。微循环明显紊乱使局部组织营养障碍,这些现象如果发生在心、脑、肺等重要脏器,则可以作为致死原因之一。
八、低剪切力环境的形成与炎症的发展和持续:
从细胞流变学角度分析,白细胞贴壁黏附受两种力的影响,一为血液流动在管壁引起的剪切力,它阻碍白细胞贴壁;另一为白细胞和内皮细胞之间的黏附力,它促进白细胞贴壁。白细胞与内皮细胞黏附能力的变化是引起白细胞在血管内膜黏附的因素,其主要途经是依赖于白细胞表面的CD11/CD18复合体抗原体系所形成的牢固黏附。当机体出现严重损伤时,如烧伤、典型的缺血-再灌注损伤等病理中,内皮细胞、白细胞感受到高浓度炎性因子的刺激而激活程度高,造成黏附能力迅速增强,可以在毛细血管后的细静脉内的流速尚未明显下降、剪切力尚未明显降低的短时间内就出现大量的白细胞黏附在内皮细胞上。然而,常见的病理大多是轻微的损伤,如运动造成的骨骼肌微损伤、非典型性缺血-再灌注损伤等,损伤部位产生的炎性因子浓度不高,内皮细胞、白细胞激活程度有限,黏附力的增强并未形成克服剪切力的优势,往往需要通过剪切力的降低来辅助完成黏附和游出的进程。这就是在一般炎症过程中可以观测到的低剪切力环境的形成和炎症的发展。
白细胞与内皮细胞的黏附是一个多步骤、序贯性的过程,上一步骤完成后需要具备一定的条件才能进展到下一步骤,白细胞和内皮细胞的相应激活是这些一定条件中的关键因素。白细胞、内皮细胞的激活也是一个多步骤的过程,并不是一次就完成了“激活”,而是分步骤、有条件的激活。需要特别引起关注的是:白细胞和内皮细胞在激活中具有相互促进和相互依赖的特征,尤其是白细胞和内皮细胞靠近时和充分接触时,相互的影响更为显著。
从白细胞黏附到内皮细胞的过程来看,低剪切力环境的形成有着至关重要的意义。一方面,白细胞和内皮细胞内部的分子机制具备了促成低剪切力环境的形成的能力;另一方面,低剪切力环境的形成促进了白细胞黏附到内皮细胞的过程。这个促进表现在以下方面:
(1)在白细胞的起始黏附进程中,低剪切力环境使白细胞趋边并与内皮细胞靠近的几率大大增加,促进了白细胞的初步激活,提高了白细胞黏附的数量;低剪切力环境使白细胞滚动缓慢,可与内皮细胞充分接触以加强激活程度,加快了白细胞黏附的进程;低剪切力环境减少了在起始黏附进程中的白细胞被冲走的比率,促成了更多的白细胞进入到牢固黏附的步骤中。
(2)内皮细胞在低剪切力环境可以成倍地增加IL-8、MCP-1等炎性因子的分泌总量,促进了白细胞的激活,促使白细胞尽快地进展到牢固黏附中。
通过上述分析,我们可以知道:在一般炎症中,低剪切力环境的形成是大量白细胞黏附和游出的前提条件,是炎症得以发展和持续的关键因素。单个的白细胞要经历初始黏附到牢固黏附并在后期游出血管,而随着炎症的进展,初始黏附和牢固黏附表现为并发的事件,共同促进低剪切力环境的形成和维持。当血液流速下降、剪切力降低时,初始黏附发生的几率更高、进程加快,牢固黏附的进程也加速,因此,炎症灶血液流变的变化和低剪切力环境的形成无疑是促进炎症发展和持续的重要因素。尤其是对于骨骼肌微损伤、骨骼肌劳损等轻微损伤诱因引起的轻微炎性反应,低剪切力环境是控制炎症强度的杠杆性要素。这种指导性认识的突破是调控炎症研究上一个飞跃,从而可以将生物力学因素作为调节炎症的一种手段来发挥抗炎作用,并将在未来获得更加广泛和更加深入的应用。