作者:王琳琳凌文华
单位:王琳琳(中山医科大学公共卫生学院医学营养系,广东广州510089);
凌文华(中山医科大学公共卫生学院医学营养系,广东广州510089)
疾病控制杂志2000年第1期第4卷讲座与综述
关键词:mtDNA;氧化损伤;自由基;抗氧化作用;修复
【摘要】
线粒体中呼吸链产生的自由基是体内自由基主要来源。在一定的生理(如年老)或/和病理条件下,自由基可以突破人体防御机制,损伤机体。由于线粒体DNA(mitochondrial DNA,mtDNA)结构功能特殊性,导致其成为自由基攻击的主要且脆弱的靶目标,从而引起线粒体功能障碍,结果造成细胞的衰老与死亡。在此将探讨mtDNA氧化损伤的形成、防御及修复机制。
自由基可以广泛攻击体内生物大分子,受损的蛋白质、脂类可经降解,再重新合成;但核酸分子损伤后一般不被降解而直接修复,未被修复的损伤DNA片段可积累下来,造成进一步更大的损害。由于mtDNA缺乏组蛋白,与氧化磷酸化场所(线粒体内膜)相距甚近,复制快速且无校读功能(proofreading)以及缺乏有效的DNA修复机制,所以mtDNA较易受自由基攻击,氧化损伤而引起突变,其突变率是核DNA的10倍。由于线粒体是机体的“动力工厂”,mtDNA损伤可导致线粒体功能缺陷,引起细胞能量不足而造成细胞的衰老与死亡。大量研究发现mtDNA氧化损伤与线粒体肌病、神经变性疾病和衰老密切相关。本文就这一氧化损伤发生、发展及防御机制的研究情况综述如下。
1 mtDNA的结构功能特征
mtDNA呈闭环双链状,独立存在于核外。每个细胞含数百个线粒体,每个线粒体含2~10个基因组DNA。人类mtDNA含16569 bp,其全部序列已被测定。它包含22个tRNA基因,2个rRNA基因,13个与线粒体氧化磷酸化有关的蛋白质基因。
与核DNA相比,mtDNA在结构和功能上有着自己独特的特征:
①mtDNA是裸露的,缺乏组蛋白和DNA结合蛋白的保护;
②mtDNA与氧化磷酸化场所(线粒体内膜)相距甚近,又直接暴露于氧化磷酸化过程中产生的高反应性氧中,因此易受自由基的攻击;
③mtDNA复制快速且催化复制的DNA聚合酶γ不具有校读功能,复制错误率高;
④mtDNA与核DNA相比缺乏有效的修复机制;
⑤每个细胞中含有数百个线粒体,每个线粒体含多个DNA分子,所以细胞中可同时存在正常mtDNA和突变mtDNA,即异质性;
⑥mtDNA无内含子,所以mtDNA的突变很容易影响到其基因组内的一些重要功能区域;
⑦突变mtDNA是否在组织产生表型效应,这要依突变mtDNA与正常mtDNA相对比例和该组织对线粒体产生的ATP依赖程度而定;
⑧线粒体是半自主性细胞器,mtDNA基因的复制、转录和翻译受核DNA的制约;
⑨线粒体位于胞质中,故mtDNA的遗传方式是细胞质遗传(母系遗传),相应地有些线粒体病亦为母系遗传,如线粒体脑肌病、糖尿病等。因此,在研究mtDNA损伤过程中必须要考虑到这些特征。
2 mtDNA氧化损伤的形成
2.1自由基的产生与Fenton反应
自由基主要来源于线粒体氧化磷酸化过程,它是指任何含有一个或多个不成对电子并能独立存在的基因,如H·、、OH·、RO·、RO2·、NO·等。约1%~2%线粒体呼吸链消耗的氧被转化为,CoQ与NADH脱氢酶是这一转化过程发生的主要位点;来源于线粒体外膜的单胺氧化酶-A/B对生物胺的氧化可以产生H2O2,这比复合物Ⅱ介导的琥珀酸氧化生成H2O2量要高48倍。
Fenton反应是针对于过渡性金属而言,过渡性金属除了一种基本状态外,还可形成不止一种的氧化态,这样就允许一个电子的氧化还原反应。Fenton与后来的Haber和Weiss研究建立了Fenton反应基本方程式:Fe2++H2O2→Fe3++HO·+HO-
细胞内Fe较Cu、Co的相对优势以及其与螯合配体高亲和力表明:Fe在体内Fenton反应中起重要作用。经Fenton反应生成的Fenton氧化剂是以·OH为典型代表,羟基化和夺取氢是其两种常见的反应形式。
金属螯合剂由于占用了金属螯合位点而可阻止Fenton反应。在哺乳动物细胞中,去Fe制剂(desferal)和啡啉(o-phenanthroline金属螯合剂)可防止H2O2引起的姐妹染色体交换、DNA单链断裂及细胞损伤。
2.2 Fenton氧化剂导致mtDNA损伤机理
在H2O2依赖性的DNA损伤中,自由基攻击对象及性质取决于Fe附着于DNA的位点而非羟自由基。Fe介导的Fenton氧化剂按DNA损伤机制至少可分为两种截然不同的类型,类型Ⅰ氧化剂对H2O2、乙醇中度敏感,并选择性裂解DNA的碱基T;类型Ⅱ氧化剂对H2O2、乙醇高度敏感,并选择性裂解DNA的碱基G。这些自由基迥然不同的损伤特征主要是由于介导产生它们的Fe所附着位置不同。
自由基攻击碱基主要导致·OH加合于富含电子的DNA双链,尤其在嘌呤N-7-C-8位点和嘧啶5、6-位点上,一般地,Fenton氧化剂可攻击DNA碱基,也可攻击糖基。攻击糖基时,先脱氧核糖链上一核糖被夺取氢,然后导致链断裂,碱基逸失。自由基攻击碱基部分并不能引起糖基改变或链断裂,除非修饰的碱基改变了N-糖苷键以允许无碱基位点形成。在被修饰的碱基中,7、8-二氢-8-氧鸟嘌呤(NULL,8-dihydro-8-oxoguanine,8-oxo-Gua)和乙二醇胸腺嘧啶(thymine glycol,及其羟化物)受到广泛的关注。可能由于同时存在独特切除酶的缘故,另外还可能由于8-oxo-Gua有高突变性和易于分离与定量。在mtDNA复制过程中8-氧脱氧鸟嘌呤核苷三磷酸(8-oxodeoxyguanosinetriphosphate,8-oxo-dGTP)有高突变率,与其在核中表现的一样,应与8-oxo-dGTP配对的A很容易被C置换,这种错配mtDNA的稳定存在为一些变性疾病奠定基因水平的基础。
对于mtDNA而言,这些碱基、糖基的改变可导致点突变、缺失和插入突变,其中以片段缺失多见。至今已发现老年人不同组织的mtDNA缺失类型有十几种,其中某些缺失只见于某类组织,而另一些缺失却可能在不同组织或器官中出现,4977 bp缺失是这些缺失中尤其普遍和研究非常多的类型。对应大鼠mtDNA的常缺失是4834 bp缺失。
2.3不依赖于Fenton反应的自由基致mtDNA氧化损伤
氮氧自由基的产生不需Fenton反应,与NO·快速反应生成ONOO-,另外ONOO-也可能与H2O2形成1-O2,这种氮氧自由基可以使DNA脱氨基并诱导其突变,还可以增强线粒体氧化应激,及细胞对过氧化物介导损伤的敏感性。存在着与Fenton反应无关的毒作用,如巴豆毒醇诱导白血球产生,并同时引起DNA单链断裂,这种损伤对H2O2水解酶不敏感,且被啡啉诱发而不是抑制。
单线态氧的产生同样不通过Fenton/H-W。例如,Cl-与H2O2反应生成OCl-,后者再与H2O2生成单线态氧,前一反应在体外被氯过氧化酶催化,在含有丰富H2O2和氯过氧化酶的嗜中性细胞中可见单线态氧的产生。单线态氧容易氧化DNA的鸟嘌呤。上述这些自由基对mtDNA的氧化损伤机理需要进一步研究。
2.4脂类过氧化导致mtDNA损伤机理
已有证据支持膜脂过氧化作用与自由基诱导的mtDNA损伤密切相关。Nakayama等在1984年发现α-生育酚可通过将氢给予脂质自由基而抑制DNA自由基的形成。两年后,他又发现α-生育酚可以阻止甲基亚麻酸过氧化氢(methyl linoleate hydroperoxide)诱导的DNA损伤。Andrew M.H.于1988年观察到作为使脂自由基失活的抗氧化剂α-生育酚可同时阻止脂质过氧化和DNA损伤;而作为自由基、H2O2、·OH清除剂的SOD、CAT和甘露醇却无此保护作用;如果说是因为这些清除剂不能进入线粒体发挥作用的话,那么对于另一具有高度膜通透性的自由基清除剂二甲基亚砜,仍不能发现其有阻止脂质过氧化和DNA损伤作用。
尽管脂质过氧化作用诱导mtDNA损伤的确切机制并未得以阐明,但可以推测脂质过氧化过程中产生的LO·、LOO·等自由基可以发挥OH相似DNA攻击作用,进一步研究仍需继续。
2.5 Cu诱导的mtDNA损伤
由于Cu可在氧化态和还原态之间反复改变,所以它是一种强的致氧化剂(prooxidant),可产生·OH等自由基,同时Cu能够形成Cu-DNA复合物,在DNA附近生产的自由基很容易攻击这个靶目标,因此Cu能引起核DNA单、双链断裂,碱基交联、氧化、置换等。可推测在Cu过载状态下,线粒体内选择性积累的Cu会以易受氧化损伤的mtDNA为靶目标。而分布于胞浆与溶酶体的Fe即便在过载状态下,亦不会积聚到线粒体,故不能诱导上述作用。若Cu清除途径发生障碍,如编码Cu-转运ATP酶的核基因发生突变,就会产生Wilson's疾病,其特征性体征就是与mtDNA损伤有关的微血管脂肪变性。
3机体抗氧化防御系统
3.1抗氧化酶类
常见的抗氧化酶有超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱苷肽过氧化物酶(glutathione peroxidase,GSH-PX)等。哺乳动物细胞在胞浆产生Cu、Zn-SOD,在线粒体内产生Mn-SOD。SOD可将转化为H2O2。当Cu、Zn-SOD、CAT、GSH-PX活性随年龄增大而降低时,Mn-SOD活性却不断增高直至60岁,而后才开始下降,而且Mn-SOD/CAT、Mn-SOD/GSH-PX活性比随年龄增大而增加,这表明自由基清除酶在60岁以前可以有效清除自由基,但60岁后,自由基的产生与清除就会失衡,而产生氧化应激,可见,自由基清除酶的功能下降与氧化应激的不断增强,对于人类衰老进程中发生中的mtDNA氧化损伤起着重要的作用。
然而有研究发现在低浓度或高浓度SOD状态下,脂质过氧化均明显,而在中度浓度SOD状态下,脂质过氧化降低到更小程度,这可能由于在脂质链式氧化过程中,可同时起启动与终止的作用。所以固然SOD抗氧化作用良好,但体内SOD浓度并非愈高愈好。
CAT与GSH-PX同时起着水解H2O2作用。在哺乳动物细胞中,CAT大多存在于过氧化物酶体中,且分泌较少,而GSP-PX则可广泛存在于线粒体、胞浆、过氧化物酶体,且作用强于CAT,特异性低于CAT,故可降解有机过氧化物,氧化的谷胱甘肽可由NADPH依赖的GSH还原酶还原。
SOD、CAT、GSH-PX三者相对水平的高低对于它们抗氧化作用的有效发挥很重要。例如,增加的SOD消耗了,但增多了H2O2,过多的H2O2若不能被CAT、GSH-PX及时清除,就会有害于机体,然而过多的GSH-PX并不必要,它过分消耗了GSH和NADPH,尽管存在着足量的CAT。
白细胞内还含有硫醇特异性抗氧化酶,在低浓度H2O2(~50μm)状态下发挥硫醇依赖的过氧化物酶的作用:高浓度H2O2(~10 mm)时,这种酶可以阻止由于硫醇/金属催化氧化造成的DNA损伤,然而这种保护作用在过氧化物酶体中并未发现。
对DNA而言,仅有效防御自由基的措施是非酶性的,组蛋白和紧密完整的染色体结构可以有效地保护DNA,然而mtDNA却缺乏组蛋白的保护及其它DNA结合蛋白,这是mtDNA对氧化损伤敏感性较核DNA高的重要原因之一。
3.2抗氧化剂
大量研究已证实,VitE、VitC在体内具有强的抗氧化特性。近年研究也发现,VitE、VitC可以延缓mtDNA遭受与衰老相关的损伤。在研究AZT(一种治疗AIDS的药物)对骨骼肌mtDNA氧化损伤作用时发现,饮食中补允VitE、VitC的病人,服用AZT的副作用明显减弱。β-胡萝卜素也具有清除自由基的作用。氧自由基连锁反应过程及其与抗氧化系统的关系可概括如下,见图1。
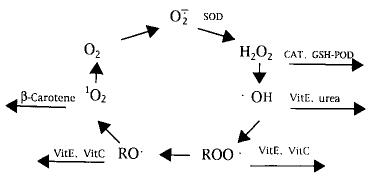
图1氧自由基连锁反应过程及其与抗氧化系统的关系
4 mtDNA氧化损伤的修复
正常状态下,机体抗氧化系统完全可以抵御自由基的攻击,一旦由于各种原因,抗氧化防御系统作用减弱或自由基产生过多而突破机体防御系统,那么mtDNA就会很容易发生损伤,这时,mtDNA的损伤修复系统就要启动。以前多数研究者认为,mtDNA缺乏有效的修复机制,然而近年来,不断的研究发现线粒体还是具有一定的DNA氧化损伤修复能力的。
4.1碱基切除修复
碱基切除修复被证实是通过一种DNA糖基酶,这种酶可以识别损伤的碱基,裂解其糖苷键。在细菌与哺乳动物细胞中有三种蛋白质参与G损伤修复:8-oxo-GuaDNA糖基酶/AP水解酶(Fpg Pro.或MutM);A DNA糖基酶(MutY),这种酶可以识别并切除与8-oxo-Gua错配的碱基A;8-oxo-dGTP酶(MutT),此酶可以水解8-oxo-dGTP,生成8-oxo-dGMP。这样,损伤的G就不会再插入新合成的DNA中。目前,Fpg Pro.与MutT类似物已经从线粒体中分离出来,线粒体中是否存在MutY类似物仍需进一步探讨。
对于单线态氧诱导的DNA碱基损伤,在线粒体中也存在着快速而有效的修复,另外线粒体内还存在AP内切酶、尿嘧啶DNA糖基酶等。
4.2核苷切除修复
这一过程需要多种酶复合体同时参与,导致一段寡核苷酸链的切除。这一复杂的修复过程目前还未在线粒体中发现。已证实对于UV诱导的二聚体,线粒体缺乏修复能力。然而线粒体却可以修复4-硝基喹啉(4-Nitroquinoline)诱导的DNA损伤,而在核内4-硝基喹啉(4-Nitroquinoline)的损伤是通过核苷切除修复途径修复的,是否有核苷切除修复蛋白质与线粒体修复过程还未知。
4.3重组修复
田鼠的mtDNA可以通过重组修复去除Cisplatin(含重金属化合物)引起的链内交联;Thyagrajan B等在体外用人体线粒体蛋白质抽提物可以在质粒间建立重组,此实验有力地支持了这一假设:哺乳动物线粒体可以利用同质性碱基重组修复损伤的DNA。
综上述所,mtDNA拥有一定的自我修复能力,然而大量研究显示mtDNA遭受比核DNA高数十倍的突变率,是否线粒体中氧化应激水平太高了,以致于即便具有效的修复系统,也不能维持一种低损伤水平?或者根本上,mtDNA的氧化损伤并不高于核DNA,而以前报告的8-oxo-dG水平偏高,可能由于分离过程中人工氧化所致?
5结束语
mtDNA的氧化损伤可导致线粒体氧化磷酸化功能障碍,从而引起细胞能量代谢削弱,造成细胞坏死和凋亡,对能量需求较高的中枢神经系统及肌肉组织会因此受到累及,而出现功能障碍甚至疾病。随着研究的不断深入,发现越来越多的疾病与mtDNA损伤突变有关,如Kearns-Sayre综合征、Leber's遗传性神经病、Parkinson's病、慢性遗传性舞蹈病等。mtDNA损伤与衰老关系也已成为目前生命科学研究的热点。所以,阐明mtDNA氧化损伤的机制在理论上和临床实践上都具有重要意义。
然而在这一领域内还需要进一步开展大量的研究工作,mtDNA氧化在整个细胞氧化应激中重要性,mtDNA损伤突变与线粒体功能缺陷、细胞凋亡关系如何,mtDNA损伤突变与衰老孰因孰果等等问题都有待于解决。
【作者简介】
王琳琳(1976-),女,安徽泗县人,在读硕士研究生
凌文华(1956-),男,安徽巢湖人,教授,博士,博士生导师,院长,主要研究方向:营养与疾病,1989~1997年在芬兰、加拿大、美国留学与工作。