唐晖谢敏豪
《体育科学》2008年08期
【作者单位】:湖南科技大学体育学院;北京体育大学运动人体科学学院;
【摘要】:
对解释肥胖的新学说——慢性炎症反应学说进行了简单的介绍,并分析了几种重要的炎症反应标志物(如白细胞介素6、肿瘤坏死因子α等)在机体组织内合成与分泌的规律,同时还简单介绍了慢性炎症反应导致肥胖的可能机制:低氧及对应激的自我保护。另外,运动对肥胖的治疗具有积极作用,简单阐述了运动缓解肥胖的机制:抗炎症反应。
目前,肥胖与糖尿病、冠心病等一系列由于代谢紊乱而形成的X综合征已成为严重影响人体健康的全球性疾病。由于X综合征共同的发病基础是胰岛素抵抗(Insulin resistance,IR),因此,近年来又有人提出胰岛素抵抗综合征(Insulin resistance syndrome,IRS)的名词。1998年世界卫生组织将这些不同的定义进行了统一,并将胰岛素抵抗综合征更名为代谢综合征(metabolic syndrome,MS)。
在以往,人们为解释肥胖形成的机制而从不同的角度提出了一些假说,如能量过剩(摄入的能量超过了消耗的能量)、肥胖基因(表达产物瘦素)、胰岛素抵抗、自由基、饮食中枢、脂肪因子(如瘦素、脂联素等)、解耦联蛋白等。虽然从不同的角度来分析时,这些假说都有一定的道理,但是,也存在一定的争议。比如能量过剩学说,肥胖的形成当然是摄入的能量超过了消耗的能量,但是摄入的能量超过消耗的能量时是通过什么途径或机制而引起肥胖的,该学说并不能清楚地给予阐明,也就是说,该学说也仅仅是肥胖形成的表层解释。至于肥胖形成的核心机制究竟是什么,目前还不太清楚。
大约从1999年开始,国外学者在分析肥胖的特征时,开始趋向于使用“慢性炎症反应状态”这个关键词进行描述。这个观点的提出是基于以下这个现象:肥胖患者体内循环血中几种炎症反应的标志物:抗炎症因子和急性期蛋白的浓度均明显上升。这几种标志物包括:白细胞介素6(interliukin-6,IL-6),肿瘤坏死因子(tumornecrosis factor-α,TNF-α),C反应蛋白(C-Reactiveprotein,CRP)和结合珠蛋白等。这种炎症反应状态(不管是全身性的还是局部的)本身出现的意义还不太清楚,然而,越来越多的证据表明,炎症反应状态可能是形成胰岛素抵抗及代谢综合征(当然包括肥胖)的重要原因。以往一般认为,肥胖会形成慢性炎症反应,而现在,在较多的实验支持下,我们认为肥胖是由于慢性炎症反应形成而形成的,慢性炎症反应是肥胖形成的重要原因。
在广泛检索文献的基础上,我们基本可以确认,国外学者对肥胖机制的新假说:慢性炎症反应学说已经被广泛接受,并且有大量学者正在对此进行研究。2005年,Lazar教授在Sccience杂志上发表了一篇论文“How obesity causesdiabetes:not a alltale”的论文,里面就明确提出肥胖处于一种炎症反应状态。在国内,仅有少数医学科研工作者在发表论文上提出肥胖与炎症反应的密切相关性,但是并没有明确提出这种假说。
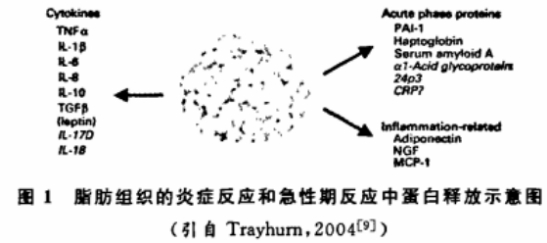
为了验证该假说的正确性,先必须搞清楚这些炎症反应的标志物究竟是由哪些组织成细胞分泌的。总的来说,有3种可能性:一种可能是这些标志物绝大部分从脂肪细胞产生和释放;第二种可能是这些标志物不是由脂肪组织,而是由其他器官合成与分泌的,这些器官主要是肝脏、免疫细胞和骨骼肌等;第三种可能性是这些标志物由白色脂肪组织(WAT)释放刺激因子而促进其他组织器官合成与释放。新研究报道表明,肥胖患者体内白色脂肪组织被巨噬细胞浸润,显示脂肪组织中的非脂肪细胞部分也可能对肥胖患者体内的炎症反应状态起重要作用。文献表明,IL-6、TNF-α等炎症反应因子均可由脂防组织中的白色脂肪细胞分泌。CRP的合成与分泌符合第三种情况,它是由肝脏合成分泌的,但是有研究表明,肥胖患者体内增多的脂肪组织释放了更多的IL-6对肝脏分泌CRP具有很强的刺激作用。既然脂肪细胞(或脂肪组织)直接(或间接)分泌这些炎症反应标志物,从而导致循环血中这些标志物的浓度明显上升,那么它对该标志物浓度上升影响的幅度又有多大?从已有文献来看,直接评定脂肪细胞分泌的标志物对循环血中上升的影响确实很难。研究起来比较方便的是测定脂肪细胞是否友达某种炎症反应标志物的基因,并分泌这些标志物。
1各种炎症反应因子
1.1 IL-6和TNF-α
研究表明,几种炎症反应因子,如IL-6和TNF-α在脂肪细胞中表达并释放。先被确认的细胞因子是TNF,主要由血管和其他基质细胞,也包括巨噬细胞分泌,在人体内发现的几种细胞因子-α。TNF-α在脂肪细胞中表达起初是在哺乳动物中被证明的,人们发现,在这些肥胖哺乳动物模型中,TNF-α显著上升。从此,人们就把TNF-α和胰岛素抵抗联系在一起。它已被证明广泛作用于胰岛素起作用的各个环节,包括抑制胰岛素受体信号通路。在人体内,尽管研究表明绝大部分TNF-αmRNA是在脂肪细胞中被人们发现的,但是,目前人们认为TNF-α在mRNA表达与蛋白分泌的不等性还需要进一步的研究。
TNF-α是脂肪组织内一种强有力的局部调节物,它以自分泌或旁分泌的形式而起作用。它能调节细胞的各种活动,包括细胞凋亡。TNF-α可能是白色脂肪组织内的一种虽重要的细胞因子,因为它在调节其他细胞因子和脂肪因子产生中起着重要作用,例如,TNF-α是调节IL-6、急性期蛋白、结合珠蛋白、神经生长因子等合成的一种重要调节物。在脂肪细胞内合成而释放入血的程度还存在争议,但是在循环血中TNF-α(包括它的可溶性受体)和肥胖标志物的关系已有学者进行了报道。
白色脂肪细胞内另外一种重要的细胞因子是IL-6。它可以在脂肪细胞内表达,其蛋白分泌物能够自分泌作用于脂肪组织,同时释放入血。肥胖及胰岛素抵抗患者体内血浆IL-6水平和白色脂肪组织内IL-6表达都明显增加。Wallenius发现,成熟期肥胖鼠的IL-6基因型缺失转基因大鼠(transgenic大鼠)和野生型对照组大鼠相比,当大鼠服用IL-6 18天后,transgernic大鼠体重明显降低,而对照组没有出现。当把重组人IL-6(rhIL-6)注射进入体时,会导致脂解作用增强。IL-6基因缺失型大鼠形成新生型肥胖,并且出现胰岛素和瘦素抵抗现象。人们认为IL-6可以直接作用于神经中枢,因为在下丘脑细胞中发现了它的受体。因此,它可能是一种将信息从脂肪细胞传递到下丘脑而调节能量平衡的物质,另外还具有此功能的瘦素。此外,在IL-6浓度和胰岛素抵抗之间,似乎存在一个“U”形剂量反应曲线:低浓度与高浓度的IL-6将导致胰岛素抵抗,而生理浓度范围内的IL-6能够提高机体组织对胰岛素的敏感性,从而抑制胰岛素抵抗的出现。Das认为,肥胖就是一种慢性炎症反应状态,而抗炎细胞因子(如IL-6)能够有效抑制肥胖。
1.2其他细胞因子及急性期蛋白
其他几种细胞因子也能在脂肪组织内合成,如IL-1β、TGF-β及瘦素。新研究又发现一些细胞因子,如IL-8、IL-10和IL-17D也具有相似作用。IL-8基因在人体脂肪细胞内表达,蛋白也能释放入血。IL-1β和TNF-α刺激IL-8释放,地塞米松抑制它的释放。与IL-6相似的是,血浆IL-8浓度在肥胖患者体内也明显上升。
循环血IL-18浓度在肥胖患者体内上升,当它们通过减肥而减少体重时,其浓度也随之下降。尽管还没有文献报道,但是我们可以推测白色脂肪组织也可以表达IL-18。与其相似的是,一种抗炎症反应因子,IL-10的循环血浓度在肥胖患者体内同样上升。已有学者报道,人体脂肪细胞、血管和脂肪基质细胞均可以分泌IL-10。
在炎症反应初期,血浆内大量急性期蛋白浓度上升,然而有少数却下降。在这些急性期蛋白中,有几种属于脂因子,这就表明脂肪组织可能是这些肥胖患者体内导致这些急性期蛋白浓度上升的来源之一。新研究发现,编码某些急性期蛋白,如α-1酸性糖蛋白和24p3的基因可以在培养的脂肪细胞中表达阳。但是脂肪细胞是否能够分泌急性期蛋白,还未见文献报道。
其他相关细胞因子还有很多,如纤维蛋白溶酶原激活抑制剂Ⅰ(Plasminogenactivator inhibitorⅠ,PAI-Ⅰ),结合珠蛋白、血浆淀粉样蛋白A(Serurn amyloid A,SAA),C反应蛋白,神经生长因子等。它们与上述几种细胞因子具有相似的特点,此处不再赘述(图1对脂肪组织的炎症反应和急性期反应中蛋白释放进行了比较详细的总结)。
2肥胖假说:慢性炎症反应的可能机制
关于慢性炎症反应导致肥胖的机制目前还不太清楚,对此学者们又提出了很多假说来对它进行解释。下面简单介绍两种比较主要的观点。
2.1低氧
不管是慢性炎症反应导致肥胖,还是肥胖导致慢性炎症反应,我们先应该考虑到肥胖(包括所有胰岛素抵抗和代谢紊乱综合征)患者体内出现慢性炎症反应的病理学和临床意义。此时的核心问题是:为什么白色脂肪组织要释放炎症反应因子和急性期蛋白?为什么随着脂肪组织的增加,这种分泌也会急速地增加?有两种可能,一种是脂肪组织仅仅是人体其他器官产生特定的炎症反应的重要刺激因素,另外一种可能就是炎症反应状态主要存在于白色脂肪组织本身。如果炎症反应只存在于脂肪组织局部,那么循环血中与炎症反应有关物质的水平的升高实际上是从该组织溢出的。
在缺乏任何实验论证的情况之下,人们习惯性地认为肥胖患者脂肪组织释放炎症因子和急性期蛋白和白色脂肪组织本身有关。如果确实如此,那么会是什么局部因素对它产生了影响呢?一种可能的解释是它可能是在渐进式肥胖形成过程中,随着脂肪组织体积的增加,脂肪基质区域性缺氧的一种反应。当脂肪组织膨胀时,血管发育(白色脂肪组织的血管比棕色脂肪组织分布本来就少些)跟不上组织的发育而不能给组织提供充分的氧气供应。这样脂肪细胞就处于相对低氧状态,这时组织细胞内出现的炎症反应就能保证血流量的增加并且促进血管生成。这与癌症中肿瘤形成时有相似之处。此观点的提出是根据以下几个事实提出的:一是脂肪组织体积对血管生成抑制剂非常敏感;二是脂肪组织体积可由它本身的血管发育调节;三是脂肪细胞能够释放几种促进血管发育的细胞因子。这些因子包括VRGF,纤维蛋白溶酶原激活抑制剂Ⅰ和瘦素等。
细胞对低氧反应的一个重要信号是产生低氧诱导因子(hypoxia-induciblefactor-1,HIF-1),HIF-1是一种异二聚体蛋白,含有α和β两个亚单位。β亚单位连续性表达,而α亚单位是受低氧刺激才高度表达,低氧是肿瘤发生的重要特征之一,此时HIF-1表达增加。这在其他一些紊乱中也经常出现,如缺血性心脏病。HIF-1作为低氧调节基因丧达的中心环节而调节各种基因的表达。HIF-1的基因表达受IL-6和TNF-α的刺激,它的靶基因包括VRCF和纤维蛋白溶酶原激活抑制剂。并且新研究表明,在低氧状况下,瘦素基因能够通过HIF-1而被转录激活。研究报道表明,低氧能刺激培养的3T3-F422A脂肪细胞中HIF-1的产生;并且,低氧还能刺激这些培养的脂肪细胞中瘦素和VRGF的基因衷达,这样低氧通过HIF-1通路面刺激脂肪组织中血管生成就成为可能。另外HIF-1表达不仅仅是培养脂肪细胞的特征,在小鼠白色脂肪组织基质细胞中,也有学者观察到了HIF-1的基因表达,并且肥胖小鼠中白色脂肪组织中HIF-1 mRNA水平与瘦小鼠相比明显增加。这个实验结果使我们把肥胖患者白色脂肪组织体积增加、脂肪细胞缺氧、炎症反应和刺激血管生成联系起来成为可能。
2.2对应激的自我保护
Fernandez认为,在免疫反应和组织修复中,机体发生低程度炎症反应可能是一种更有效的使葡萄糖从骨骼肌转向免疫细胞的方式。这样机体为了应付主要的应激,如感染或饥饿,机体不得不提高外周组织的胰岛素抵抗,以保证大脑及中枢神经系统的葡萄糖供应。该假说解释了为什么主要的应激激素——皮质醇,能够引起胰岛素抵抗,并且刺激天然免疫系统的功能。该应激状态可能会趋向于向机体内各个细胞扩散,因为近来有研究表明,细胞内应激以某种方式引起胰岛素抵抗,并且在肥胖时由于脂肪细胞分泌的各种脂因子而更加严重。于是慢性炎症反应状态抑制胰岛β细胞分泌足够胰岛素来克服胰岛素抵抗的能力,因此而形成了胰岛素抵抗为核心环节的各种代谢紊乱综合征,当然也包括肥胖。
3运动的抗炎症反应作用
众所周知,有规律的适度的运动对减肥、预防与缓解胰岛素抵抗及心血管疾病具有重要作用。如上所述,这些代谢综合征,如肥胖,很有可能是由低程度的慢性炎症反应引起的。而巧合的是,目前,在国外,学者们已普遍接受了运动的重要意义:抗炎症作用。然而,在国内的文献中,还很少看到运动具有抗炎症反应的提法和研究文献。
有较多的研究显示,在健康成年人,老年人及代谢综合征患者(包括肥胖)中,不经常运动与低程度全身性炎症反应紧密相关。Sheu的研究结果表明,以运动为基础的12周减肥运动方案使非糖尿病妇女体重减少5%,同时激活体内NF-kappaB和NF-kappa B调节的几种抗炎症基因的转录,充分说明运动减肥的重要作用:抗炎症。Drexel的实验则显示,离心耐力运动是一种改善代谢和促进抗炎症反应的新的运动方式,该运动方案特别适合久坐不动的人群。
肥胖患者体内脂肪组织可以产生多种炎症反应因子,然而,在探讨运动的抗炎症反应作用时,IL-6和TNF-α是两个紧密联系的,并且和抗炎症反应密切相关的细胞因子,其他某些细胞因子似乎没有在运动的抗炎症效应中发挥作用,如瘦素。新研究表明,在一套运动训练方案中,初次急性运动就降低了胰岛素抵抗,但是血瘦素水平却没有显著性影响改变。C反应蛋白在运动的抗炎症效应中有所作用,但研究的文献并不多,有两个纵向研究结果表明,有规律的运动训练可以降低胰岛素抵抗患者体内的C反应蛋白水平。急性运动表明IL-6和TNF-α是紧密联系的,一方面TNF-α能刺激IL-6产生,而另一方面,离体与在体研究均表明,IL-6能够通过刺激IL-1ra和IL-10产生而形成抗炎症环境,同时它也能抑制TNF-α产生。并且,给受试者服用IL-6也能引起血浆IL-6浓度的增加,这一点与运动引起血浆IL-6增加相类似,此时会抑制内毒素引起的TNF-α的升高。因此,IL-6应该归类为抗炎症因子,运动引起血浆儿茶酚胺水平增加,近来也有研究表明,去甲肾上腺素注射能够抑制内毒素诱导的在体TNF-α产生,并且增加IL-10的释放。因此,运动很有可能通过抑制TNF-α产生而发挥抗炎症作用,但是,运动抑制TNF-α产生可能不是通过IL-6信号通路。因为在IL-6基因敲除大鼠运动后,与野生型大鼠相比,TNF-α只有轻度的降低。有研究表明,运动抑制TNF-α产生可能是通过去甲肾上腺素信号通路,因为运动诱导体内产生大量的去甲肾上腺素,同时去甲肾上腺索注射也能抑制体内内毒素引起的TNF-α产生。而同时去甲肾上腺素注射只引起少量的IL-6增加,说明IL-6与去甲肾上腺素抑制TNF-α产生的机制是不同的,运动抑制TNF-α产生可能是通过去甲肾上腺索信号通路。图2对IL-6和TNF-α在运动的抗炎症反应中的作用进行了简单的总结。
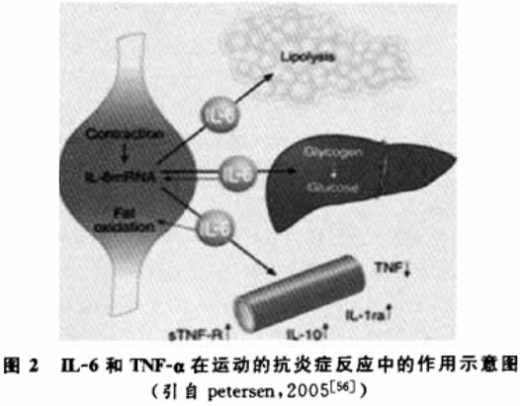
关于运动的抗炎症反应的机制,目前研究得更多的是上述IL-6和TNF-α两种细胞因子,同时学者们也正在对其他可能机制进行研究,如Radom的实验表明,30min的有氧运动可以激活人体中性粒细胞内各种以前人们所未知的各种基因大量显著性地表达。说明运动的抗炎症反应属性还有着目前并不所知的机制,需要进一步的研究。