周锦琳田野
《北京体育大学学报》2005年09期
【作者单位】:北京体育大学
国家体育总局体育科学研究所
【摘要】:
研究表明,运动引起胞浆Ca2+聚积是骨骼肌疲劳的重要原因。从研究酸性刺激时胞浆Ca2+的变化入手,从细胞水平分析急性运动可能对骨骼肌胞浆钙稳态的影响,试图为全面了解运动性疲劳的产生机制提供理论依据。实验中以Fluo-3-AM为Ca2+荧光指示剂,通过激光扫描共聚焦显微镜系统对用体外组织分离和培养的方法获得的单个的骨骼肌细胞胞浆Ca2+的荧光强度及其动态变化进行观察。
结果发现:骨骼肌细胞受到酸性刺激时,胞浆Ca2+稳态被破坏。其总体变化趋势是先略有增加后迅速减少,直至在比正常低的水平上形成新的动态平衡。钙波的变化既有振幅的变化,也有频率的变化。这可能提示:运动后,由于内环境酸性代谢产物的堆积,致使胞浆Ca2+稳态破坏,终引起骨骼肌疲劳。
骨骼肌疲劳一直是教练员和运动员非常关注的热点问题之一。随着研究的不断深入,越来越多的研究发现胞浆钙水平变化与骨骼肌机能之间存在着联系。大量的研究表明,运动引起肌浆网和线粒体转运Ca2+能力下降,胞浆Ca2+聚积是骨骼肌疲劳的重要原因。但是直至目前,有关运动后骨骼肌细胞胞浆钙聚积的直接证据却很少。
从细胞信号转导的角度来看,胞浆Ca2+是细胞的第二信使。为了能够准确地传递各种信息,细胞的钙转移系统(如细胞膜、肌浆网和线粒体钙转移系统等)必须时刻转移Ca2+,把胞浆Ca2+维持在较低水平。但是,胞浆Ca2+不是一成不变的,而是处于一种动态变化中。细胞外液的各种刺激因素如PH值、温度等变化,都可造成Ca2+细胞信号的改变。运动中,细胞外液的PH值会由于乳酸的产生而下降,pH下降又会造成骨骼肌肌浆网和线粒体摄取和释放钙能力的变化,从而影响到胞浆Ca2+水平。但是,以前的研究更多地集中某个时刻Ca2+的浓度变化。据此,本论文以研究酸性刺激时胞浆钙的变化为切入点,连续观察一段时间内胞浆Ca2+的变化,力图系统地分析急性运动可能对骨骼肌细胞钙稳态的影响,为全面了解运动性疲劳的产生机制提供理论依据。
1研究方法
1.1溶液的配制
1.1.1磷酸盐缓冲液(PBS溶液)
0.20 g KH2PO4,0.20 gKCl,2.90g Na2HPO4 12H2O和8.00gNaCl溶解于800mL重蒸水中,之后加水至1 000mL。再用0.1M盐酸配制pH值为6.9的PBS溶液。
1.1.2 DMEM培养液
DMEM干粉1包(或1瓶),Hepes.95g,青霉素(100IU/mL)66mg,链霉素(100μg/mL)154 mg,NaHCO3 2.2g。将上述药品溶解于1000mL超纯水或三蒸水中,调pH值至7.0。配好后除菌过滤,分装于500mL盐水瓶,400mL/瓶,4℃保存。
1.1.3胎牛血清
将胎牛血清在56℃40min灭活,4℃保存。使用前,将胎牛血清与DMEM培养液在无菌条件下按体积比1:10的比例混合,使胎牛血清的终止工作浓度为10%。
1.1.4 0.25%胰蛋白酶消化液(含0.02%EDTA)
胰蛋白酶(活性为1:250)2.50g,EDTA 0.20g溶解于100mL PBS溶液中,4℃冷冻24h后,滤器过滤,无菌分装置于低温冰箱(-20℃)保存。使用时稀释10倍。
1.1.5 Fluo-3-AM的配制
1mg Fluo-3-AM溶解于0.805mL DMSO中,冻存。使用时取20μL Fluo-3-AM储存液溶解于1980μLPBS溶液中,浓度10μmol/L。
1.2骨骼肌细胞的制备
出生后1~3 d的Wister大鼠3~6只(由军事医学科学院动物中心提供),采用颈椎脱位方法处死动物。消毒后取出两侧腿部肌肉剪碎,0.25%胰蛋白酶液消化及分散组织块,离心,沉淀部分加入的含有胎牛血清的DMEM培养液,吹打成细胞悬液。接种后,放入37℃CO2培养箱中进行培养。细胞接种后体外培养至第3 d后,细胞生长状态良好,开始实验。
1.3测试指标
骨骼肌细胞胞浆Ca2+的荧光强度及其动态变化。
1.4测试仪器
美国Bio-Rad公司生产的MRC 1024型激光扫描共聚焦显微镜系统。
1.5测试过程
把培养的细胞用PBS溶液漂洗3次;接着用Fluo-3-AM工作液37℃孵育30min然后再用PBS溶液漂洗3次。
把细胞培养皿置于激光共聚焦显微镜的载物台上,488nm波长激光激发Fluo-3-AM发生荧光,然后在高倍油镜下检测。选择合适视野后,开始扫描。每个细胞样本均先连续扫描100~200sec测基础荧光强度,并观察强度稳定后,分别加入不同PH值的PBS溶液50μL,继续扫描,动态观察细胞内荧光强度的变化。每组观察6个培养皿,每个培养皿观测1~2个细胞。
1.6试剂和药品
Fluo-3-AM、DMEM、Heres为SIGMA公司产品,胰蛋白酶为GIBCO-BRL公司生产,EDTA为美国BioRad公司生产,胎牛血清为天津市川页生化制品有限公司生产,其余化学试剂均为国产分析纯试剂或试剂。
1.7数据分析与图象采集
数据用EXCEL软件分析处理;图象用Confocal Assistant 4.02和Adobe Photoshop 6.0软件采集处理。
2实验结果
胞浆Ca2+的荧光强度直接反映了骨骼肌细胞胞浆Ca2+的水平,其变化包括振幅和频率的变化两个方面。图1为正常情况下胞浆Ca2+荧光强度的变化。从图3可以看出,大约在30~230sec这段时间内,即细胞处于正常安静状态时,胞浆Ca2+荧光强度在一定的基线上波动,形成了近似于正弦波形的钙波,振幅约为50μmol/L,频率约为0.02 HZ(100 sec振动约2次)。


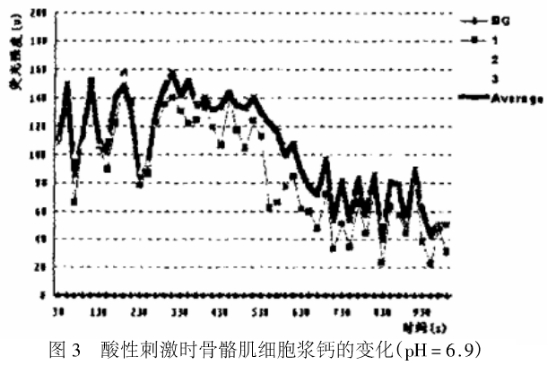
当加入pH=6.9的PBS后(图2、图3),胞浆Ca2+的荧光强度总体变化的趋势是先略有增强后迅速减弱,直至在比正常低的水平上形成新的动态平衡。钙波振幅的变化是先快速增大(由正常时的水平增加至60μmol/L)后迅速减小(20~30μmol/L);频率则是先减小(0.015HZ,400sec振动约6次)再增大(0.03HZ,100SeC振动3次)。
3分析与讨论
根据细胞信号转导的理论,Ca2+是一种细胞内通讯的化学信号。胞浆Ca2+作为第二信使,在维持机体的正常生理功能方面起着非常重要的作用,几乎一切生命现象都与Ca2+有关。细胞钙信号的产生与终止是胞浆内Ca2+增减和波动的结果。当某种外界刺激达到细胞表面时,处于细胞膜、内质网(或肌浆网)及线粒体膜上的钙通道开放,钙泵的运载作用加强,使得胞外或胞内钙库中Ca2+释放至胞浆中,胞浆中的Ca2+浓度增高,这就产生了钙信号。
细胞在正常情况下即处于安静状态时,胞浆Ca2+水平一生所谓的钙波。在本实验中,胞浆Ca2+的荧光强度反映了骨骼肌细胞胞浆内Ca2+水平。从图3可以看出,大约在30~230sec这段时间内,即骨骼肌细胞处于正常安静状态时,胞浆Ca2+形成了近似于正弦波形的波动,振动的周期约为50sec,振幅约为50μmol/L。以上结果说明骨骼肌细胞胞浆Ca2+在安静时的变化符合细胞信号转导理论的观点,即正常状态下的骨骼肌细胞胞浆Ca2+以钙波的形式,周期性振荡,始终处于动态平衡中。
运动时,肌肉是生成乳酸尤其多的部位。有报道在进行短时间至大强度静力性运动和次至大强度动力性运动时,肌乳酸由安静时每千克干肌重4mmol增加到94~114mmol,肌细胞内pH值由安静时7.0的降到6.5~6.9。Byrd等在实验中测得Ca2+-ATP酶活性下降,pH也明显下降,肌肉中乳酸浓度增加了3~4倍。为此,本实验中选用pH值为6.9的PBS缓冲液作为酸性刺激。
当骨骼肌细胞受到酸性(pH=6.9)刺激时,胞浆Ca2+水平出现了很明显的变化(如图2,图3),总体趋势是先略有增加后减少,直至在比正常低的水平上形成新的动态平衡。造成这种现象的原因可能与细胞内H+的变化有关。当细胞外液H+浓度增加时,H+进入细胞内。细胞膜上的钙泵具有Ca2+/H+交换能力,可以运进细胞内2个H+,向细胞外转运出1个Ca2+。细胞膜上的Na+/H+交换体也可以向细胞内转运H+。H+进入胞浆,Na+被转运出细胞外。细胞膜上的Na+/Ca2+交换体继而可以作用,把Na+再转运回细胞,同时再把Ca2+排出细胞外。上述作用的结果使得胞浆内H+浓度增加,而胞内Ca2+水平下降。为了不使胞浆Ca2+水平下降,继续维持胞浆Ca2+稳态,细胞内的钙库就会起作用。它们可能释放出大量的Ca2+进入胞浆,因而造成胞浆Ca2+增多。但是当胞内Ca2+增多超过正常水平时,Ca2+释放会通过负反馈作用而停止。细胞膜上的钙泵和Na+/Ca2+交换体,肌浆网膜和线粒体膜上的钙泵或Ca2+转运体就会把细胞内多余的Ca2+转运出胞浆,引起胞内Ca2+水平下降,在比正常低的水平上重新形成新的Ca2+稳态。
已有的大量研究通过运动后骨骼肌细胞钙转移系统Ca2+转运能力下降都推测运动至疲劳时骨骼肌细胞胞浆Ca2+聚积。得出此结论的依据主要有二个方面:一是运动引起肌浆网钙转移系统Ca2+转运能力下降。Pierce等发现鼠进行1次力竭性游泳后,肌浆网钙摄取能力下降,而钙结合能力未受影响;3次力竭后,肌浆网钙摄取和钙结合能力都显著性下降。李洁发现大鼠长时间持续性跑台运动后,红肌和白肌肌浆网的Ca2+-ATP酶活性都下降;红肌Ca2+转运初始速率和至大Ca2+转运能力也有变化。二是运动引起线粒体钙转移系统Ca2+转运能力下降,线粒体钙聚积。Duan等让鼠进行下坡跑,结果运动后即刻肌肉内线粒体Ca2+浓度与对照组相比均有显著性增加;48 h后,这种变化更加明显;同时还发现未受损伤肌纤维数与线粒体Ca2+浓度值呈负相关。田野等发现大鼠90mins间歇性下坡跑运动后即刻和运动后24h与运动前相比,线粒体钙含量分别显著地增加;运动后48h,线粒体钙含量开始恢复,但仍高于运动前水平。大鼠持续200mins下坡跑后24 h线粒体钙含量非常显著地上升,比对照组增加了81.77%。周锦琳等研究发现大强度运动后即刻大鼠骨骼肌线粒体Ca2+-ATP酶活性略有变化,但无显著性差异;但在中等强度长时间运动后却非常显著地下降。把上述实验结果概括起来就是,运动能力下降时,细胞内钙库——线粒体和肌浆网的钙泵转运Ca2+的能力下降,线粒体钙聚积,终导致骨骼肌细胞的机能紊乱。
本研究中当骨骼肌细胞受到酸性刺激时,骨骼肌细胞胞浆Ca2+稳态受到了破坏。胞浆Ca2+经历了一个先升高再降低,然后在比正常低的水平上重新建立稳态的过程,研究中并未发现骨骼肌细胞在受到酸性刺激后有明显的胞浆钙聚积现象,这与上述研究的推测结果不一致。这可能与二个因素有关:一是与运动强度、运动阶段受到的刺激不同有关。上面提到的研究大多数采用大强度或中等强度长时间运动或力竭性运动,测量的大多是运动结束时或运动后恢复期Ca2+-ATP酶活性或线粒体钙含量,由此在推测胞浆Ca2+的变化。运动强度较大,运动时间也较长,因而骨骼肌细胞中堆积的H+浓度也较高,这可能造成胞浆钙的不可恢复性升高。二是与刺激的方式有关。本研究中采用的是体外模拟刺激的形式,在细胞外施加酸性刺激使细胞内酸浓度增加,这与运动中细胞内酸浓度增加后造成细胞外液的酸浓度增加不同。另外,本实验刺激的程度较低(pH=6.9),刺激的时间也比较短。细胞虽受到了酸刺激,但仍可以依靠自身调节维持胞浆Ca2+的稳态。本研究中虽未发现骨骼肌细胞胞浆有明显的Ca2+聚积现象,但可以肯定的是当细胞外液pH值下降时,骨骼肌细胞胞浆Ca2+稳态受到了破坏。上述结果可能提示:在不同强度急性运动时,或在运动的不同阶段,骨骼肌细胞内胞浆Ca2+变化可能不同。在运动的初期,肌细胞pH值下降,但由于刺激时间短,酸性作用不强,骨骼肌细胞的胞浆Ca2+水平虽然上升,但仍能通过细胞内线粒体和肌浆网等钙转移系统重新调节胞浆Ca2+稳态。随着内环境酸性程度的不断加重,钙转移系统的机能可能会减弱,以至于造成胞浆钙聚积。
骨骼肌细胞内H+浓度升高,胞浆Ca2+水平下降,这也是对正常胞浆Ca2+稳态的一种破坏,它也会给运动能力带来影响,直接的影响就是降低肌肉的张力。如果要达到某一张力,就需要比正常时更多的Ca2+,这无疑又会影响到肌浆网的功能。若此影响长期存在,那终究还是要降低骨骼肌的机能。
本研究还发现当骨骼肌细胞受到酸性刺激时,钙波不仅只有振幅的变化,还有频率的变化,振动频率先减小再增大。这可能也是钙稳态的改变的一种方式。有研究报道,钙波频率的变化不应是偶然的因素,它可能也有意义。在H+持续刺激的情况下,Ca2+信号如果振荡过大会造成骨骼肌细胞的损害,频率变化的方式减少了这种危险。如果胞浆Ca2+持续保持在较高水平,这就会造成骨骼肌细胞的的脱敏效应,以使得其它需要Ca2+表达的信息无法表达。钙波频率的改变也许还有减少脱敏作用的意义。若果真如此,那么在加入酸后,钙波之后下降到低水平上更快速的振荡的意义就十分明显。一是可以避免胞浆Ca2+聚积对细胞造成的损害;二是可以保持细胞通过钙信号表达的信息的正常传递。
按照细胞信号转导理论的观点,胞浆Ca2+稳态是细胞许多信息正常传递的基础,细胞的钙转移系统会尽可能地保持胞浆Ca2+的稳定,从而维持细胞的正常机能。某一时刻胞浆Ca2+增多或减少都不能全面反映Ca2+对细胞功能的影响。因而,本研究认为,急性运动中钙转移系统机能下降,从而造成胞浆Ca2+稳态的破坏,骨骼肌细胞信号转导异常可能是导致骨骼肌疲劳的原因。
4小结与建议
1)骨骼肌细胞处于正常安静状态时,胞浆Ca2+水平在一定的基线上波动,形成了近似于正弦波形的钙波。骨骼肌细胞处于酸性环境中,胞浆Ca2+水平的总体变化趋势是先略有增强后迅速减弱,直至在比正常低的水平上形成新的动态平衡。钙波的变化既有振幅的变化,也有频率的变化。这种变化的原因可能与胞浆内H+浓度升高有关。
2)本实验中未发现骨骼肌细胞在酸性环境中胞浆有明显Ca2+聚积现象,这可能与体外模拟刺激的形式有关。结果提示:在不同强度急性运动时,或在运动的不同阶段,骨骼肌细胞内胞浆Ca2+变化可能不同。在运动的初期,酸性作用不强时,细胞通过线粒体和肌浆网等钙转移系统可以重新调节胞浆Ca2+稳态。随着机体内环境酸性程度的不断加重,细胞自身的这种调节作用可能会下降。胞浆Ca2+稳态的破坏可能是导致急性运动时骨骼肌疲劳的原因。
胞浆Ca2+始终处于动态变化中,如何采用更加科学合理的方法对胞浆Ca2+进行测定,仍是一个迫切需要解决的问题。