作者:唐戎成敏聂永梅陈槐卿
机构地区:四川大学华西医学中心生物医学工程实验室,成都610041
出处:《生物医学工程学杂志》
核心刊IC CAS CSA JST AJ PUBMED CSA-PROQEUSTSCOPUS ZGKJHX CSCD
2004年第3期363-366,共4页
摘要:
血管内皮细胞衬于血管腔的表面,是血流机械应力的主要感受者。切应力可以直接调节内皮细胞生物活性物质的合成和分泌,其中包括诱导内皮细胞生成IL-8,而且IL-8的生成量与切应力作用时间有关。为阐明内皮细胞IL-8的生成除了与切应力的作用时间有关外还与切应力的强度有关,我们用不同强度的流体切应力(2.09、4.61、6.19、8.51、10.50、12.59、14.41、17.22、18.32dyne/cm2)处理培养的人脐静脉内皮细胞,然后采用双抗体夹心ABC-ELISA技术检测内皮细胞IL-8蛋白质的生成。
结果显示:未用切应力处理的内皮细胞只有极少量的IL-8蛋白质生成;切应力处理内皮细胞后,低切应力(2.09dyne/cm2)时IL-8蛋白质生成量明显增加,约为高切应力(18.32dyne/cm2)时IL-8蛋白质生成量6(作用5h)7倍(作用6h)。IL-8蛋白质生成量与内皮细胞所施加的切应力强度呈反变关系;直线回归方程:5h时为y=760.12-36.06x,相关系数7=-0.978;6h时为y=781.87-36.66x,相关系数7=-0.980。
式中:
y为切应力作用下内皮细胞IL-8的生成量;
x为施加于内皮细胞的切应力强度(dyne/cm2)。
不同的切应力作用时间(5h、6h)均表现出相同的IL-8蛋白质生成量随切应力强度的变化规律。
提示流体切应力诱导内皮细胞生成IL-8的量,不仅与切应力的作用时间有关,而且IL-8的生成量与切应力强度有关。流体低切应力诱导内皮细胞IL-8的生成量急剧增高,可能在急性炎症和动脉粥样硬化的发生、发展过程中具有重要作用。
1前言
血管内皮细胞(Endothelial cells,ECs)衬于血管腔的内表面,是血流与血管壁相互作用的界面,是血流机械应力的主要感受者和信号传导者。血管内皮细胞所受到的机械应力一般分为3种:血流的剪切应力、血管壁的周向应力和血流的法向应力。其中血流的剪切应力通过血管内皮细胞切应力感受器传递和转导力学信号,调节着内皮细胞的结构和功能。目前已发现血管内皮细胞在流体切应力作用下可以表达多种趋化性细胞因子,如单核细胞趋化蛋白-1(Monocyte chemotactie protein 1,MCP-1)、生长调节癌基因(Growth regulated oncogene,GRO)、白细胞介素-8(Interleukin-8,IL-8)等,并证实力学刺激通过调节血管内皮细胞表达IL-8来参与炎症性疾病和动脉粥样硬化的发生、发展和预后过程。流体切应力作用于内皮细胞不仅可以诱导生成IL-8,而且IL-8蛋白质的生成与切应力的作用时间有关。但内皮细胞在切应力作用下IL-8蛋白质的生成量是否与切应力强度有关,国内外尚未见报道。因此,本实验采用双抗体夹心ABC-ELISA技术来研究流体切应力的强度对培养的人脐静脉内皮细胞(Human umbilical vein endothelialcells,HUVECs)IL-8蛋白质生成的影响,以期了解流体切应力的强度是否也能影响内皮细胞IL-8蛋白质的生成以及其强度依赖性的变化规律。
2材料与方法
2.1人脐静脉内皮细胞的培养与鉴定
根据Jaffe等的方法,本室加以改进。培养的内皮细胞在相差显微镜下呈多角形、单层铺路石状排列。透射电镜下,胞浆内有Weibel-Palade小体。免疫组织化学染色可见Ⅶ因子相关抗原阳性。
2.2流室系统
由一块有机玻璃平板和一块玻璃盖板组成。两块板之间有环形硅橡胶垫圈,可防渗漏。安装后的流室的尺寸为:长8.5cm,宽2.5cm,高0.3mm。流入孔和流出孔间距离为7.0cm。经理论计算,流室测试区满足:
(1)层流;
(2)二维流动;
(3)充分发展流动。
2.3切应力处理内皮细胞
将传至2~4代的内皮细胞接种到载玻片(7、5cm×2.5 cm)上,待长满汇合后转移到流室的测试区。密封后进行流体剪切实验,由Model 7518-10型蠕动泵(ColeParmer公司,美国)为实验中的灌流系统提供稳定的定常流(Sready flow),分别选取2.09、4.61、6.19、8.51、10.50、12.59、14.41、17.22、18.32dyne/cm2的切应力处理内皮细胞。处理时间分别为5h和6h。以未做任何处理的内皮细胞做为对照。实验时流室内保持37±1℃,培养液中的缓冲体系可维持pH值在7.2~7.4之间。整个灌流系统处于同一水平面。实验结束后收集培养液,-20℃保存待测。
2.4 IL-8含量的测定
用人IL-8定量EIASA试剂盒(上海森雄科技实业有限公司),采用双抗体夹心ABC-ELISA法检测培养液中的IL-8含量:将待测液(100μl)依次加入鼠抗人IL-8单抗包被的96孔微孔板,37℃孵育2 h后洗板;加入辣根过氧化物酶(HRP)耦联多抗(50μl),37℃孵育1h后洗板;加入100μl底物工作液,置37℃显色5~10min;加入50μl 2 mol/lH2SO4终止反应,在492nm处测吸光值,根据标准曲线计算IL-8蛋白质浓度。
3结果
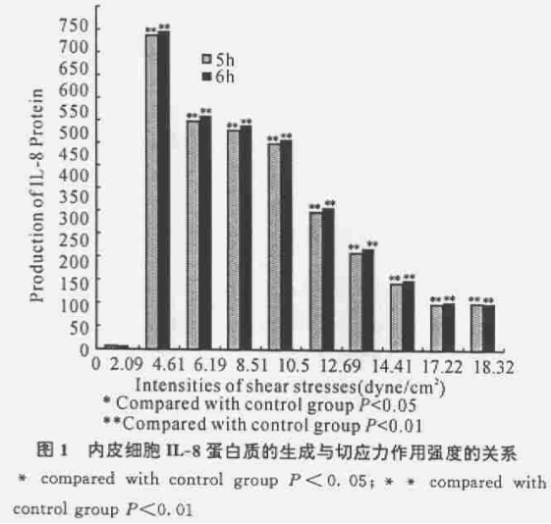
静态培养的HUVECIL-8蛋白质有低水平的基础表达,表达量在5.674±0.851~6.398±0.634pg/ml之间;当流体切应力作用时间为5h,切应力强度分别为2.09、4.61、6.19、8.51、10.50、12.59、14.41、17.22、18.32dyne/cm2时,IL-8蛋白质生成量明显增加,分别为684.045±5.334、495.346±8.532、475.547±3.366、446.043±5.633、297.356±5.323、209.083±8.552、141.851±0.562、98.469±0.662、99.5±0.965pg/ml;当流体切应力作用时间为6h,相同切应力条件下IL-8蛋白质生成量进一步增加,分别为694.727±5.122、508.090土8.333、486.043±6.546、455.882±8.963、307.557±6.582、218.336±3.342、149.947±6.563、101.5±0.956、100.26±0.556 pg/ml。切应力为2.09dyne/cm2时,IL-8蛋白质生成量高,约为切应力18.32dyne/cm2时IL-8蛋白质生成量的6~7倍,IL-8蛋白质的生成量与施加于内皮细胞的切应力强度呈反变关系。经用SPSS10.0统计软件对切应力强度及其对应的IL-8蛋白质生成量进行回归与相关分析,按α=0.05水平拒绝无效假设。切应力强度与对应的IL-8蛋白质生成量之间的直线回归方程为:
y=760.12-36.06x,相关系数r=-0.978(5h)
y=781.87-36.66x,相关系数r=-0.980(6h)
式中:y为切应力作用下内皮细胞IL-8蛋白质生成量(pg/ml);
x为施加于内皮细胞的切应力强度(dyne/cm2)。
对直线回归和相关系数分别进行假设检验,均为p<0.05,具有统计学意义(见图1)。
4讨论
4.1切应力强度影响内皮细胞IL-8的生成
内皮细胞在其整个生命活动过程中始终受到血管中的血流机械应力作用。在长期的力学环境中,内皮细胞获得了对力的类型、大小敏感的机制。内皮细胞能够感知所处环境中力学因素的变化,并做出形态、结构和功能上的调整以适应力学环境的改变。
本实验室张文胜等发现流体切应力可以诱导内皮细胞表达IL-8基因,而且IL-8mRNA的表达量与切应力的作用强度有关,呈反变关系,但IL-8蛋白质的表达量与切应力的作用强度是否有关,仍是需要进一步研究的问题。因为众所周知,蛋白质才是生命功能的真的执行者。以往的研究发现在层流切应力作用下,切应力诱导内皮细胞趋化性细胞因子的合成和分泌具有强度和时间依赖性。如Yu等报道4dyne/cm2的切应力作用内皮细胞MCP-1蛋白质的生成量比10dyne/cm2组明显增高,邢海燕等报道0.72dyne/cm2的切应力作用内皮细胞5h MCP-1蛋白质的生成量比2.4dyne/cm2组明显增高,这与我们的结果是一致的。本研究也发现低切应力时内皮细胞IL-8蛋白质的生成量较高,而在高切应力时IL-8蛋白质的生成量较低。IL-8蛋白质的生成量与切应力强度呈反变关系,低切应力通过什么机制诱导了内皮细胞IL-8蛋白质的合成和分泌?高切应力又通过什么机制抑制了内皮细胞IL-8蛋白质的合成和分泌?这些都是非常有趣和值得深入探讨的问题。
4.2不同强度切应力影响内皮细胞IL-8生成的临床意义
临床上发现动脉粥样硬化斑块好发生在动脉的分枝开口处和弯曲动脉的凸面,特别是动脉分叉处的外侧壁。这往往是血流方向紊乱和低切应力区域(≤4dyne/cm2),大大低于其他直通的血管区域(≥15dyne/cm2)。当切应力≥15dyne/cm2时,可以诱导内皮细胞NO的释放,刺激组织纤溶酶原激活物的表达,并减少其抑制物的表达,阻止内皮细胞凋亡;减少内皮细胞受损后炎症前细胞因子的激活;抑制平滑肌细胞的迁移,抑制内皮细胞趋化性细胞因子、黏附分子等的表达;诱导内皮细胞抗粥样硬化基因的表达。因而具有抗动脉粥样硬化作用。而低切应力(≤4dyne/cm2)对内皮细胞的调节作用正与此相反,促进内皮细胞增生、白细胞黏附,因而具有促动脉粥样硬化作用。另外临床上急性炎症往往伴有剧烈的血流动力学变化。切应力对炎症反应有调节作用,例如切应力使内皮细胞细胞间黏附分子-1(Intracellular adhesionmolecule-1,ICAM-1)的表达上调,增加白细胞与内皮细胞的黏附;生理范围的切应力使中性粒细胞出现聚集,在聚集细胞的接触部位F-肌动蛋白聚合化,并伴有细胞内Ca2+浓度升高。低切应力区域,如我们实验中所用的2.09dyne/cm2(相当于微静脉水平,2.10dyne/cm2)、4.61dyne/cm2(相当于毛细血管后静脉水平,4.60dyne/cm2)、6.19dyne/cm2(相当于小静脉水平,6.10dyne/cm2),这正是急性炎症时中性粒细胞渗出血管并向炎症中心趋化的部位。在切应力的作用下,内皮细胞分泌IL-8。IL-8激活中性粒细胞运动装置,使其定向游走(趋化作用);促使其表达黏附分子;刺激中性粒细胞脱颗粒和呼吸爆发,促进溶酶体酶释放;促使胞浆内Ca2+浓度升高,使胞浆的48KDa蛋白磷酸化,在切应力和其它因素的共同作用下,形成了急性炎症时复杂的病理生理变化。我们认为低切应力可能是通过IL-8来介导急性炎症发展过程的。另外,在动脉的分枝开口处和弯曲动脉的凸面等低切应力区域,切应力诱导内皮细胞表达IL-8,IL-8趋化单核细胞和淋巴细胞到该部位,并同时介导单核细胞在内皮细胞上的滚动和牢固黏附,可能是动脉粥样硬化作用的始动因素之一。而在高切应力(17.22、18.32dyne/cm2)时IL-8的生成量明显降低,则可能具有抗动脉粥样硬化的作用。